LE LEGGI DEI GAS E L'EQUAZIONE DI STATO.
I GAS PERFETTI O IDEALI.
Per gas ideale si intende un gas che possieda le seguenti proprietà:
- le molecole sono puntiformi e pertanto hanno un volume trascurabile;
- interagiscono tra loro e con le pareti del recipiente mediante urti perfettamente elastici (ovvero non vi è dispersione di energia cinetica durante gli urti);
- non esistono forze di interazione a distanza tra le molecole del gas: le molecole si dicono non interagenti;
- le molecole del gas sono identiche tra loro e indistinguibili;
- il moto delle molecole è casuale e disordinato in ogni direzione ma soggetto a leggi deterministiche.
In conseguenza di ciò:
- il gas non può essere liquefatto per sola compressione, ossia non subisce trasformazioni di stato;
- il calore specifico è funzione della temperatura;
- l'energia interna è data solamente dall'energia cinetica, non da quella potenziale; essa rimane costante e non viene dissipata.
In un gas ideale l'energia cinetica media delle molecole del gas è direttamente proporzionale alla temperatura:
I gas ideali vengono descritti dalla legge dei gas perfetti con buona approssimazione solo quando la pressione è sufficientemente bassa e la temperatura è sufficientemente alta.
LEGGE DI BOYLE - MARIOTTE.
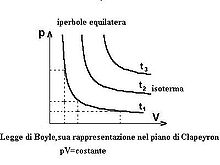
In termodinamica la legge di Boyle e Mariotte (o semplicemente legge di Boyle) afferma che in condizioni di temperatura costante la pressione di un gas perfetto è inversamente proporzionale al suo volume, ovvero che il prodotto della pressione del gas per il volume da esso occupato è costante:
oppure:
Tale costante è funzione (crescente) della temperatura assoluta, della natura del gas e del numero di moli.
La legge può essere scritta anche con la seguente notazione più completa:
nella quale viene indicato che la legge vale a temperatura costante, ovvero che la costante varia con la temperatura.
Condizioni di validità

La legge di Boyle e Mariotte è sperimentalmente verificata per gas che si comportano come un gas ideale, oppure per gas in condizioni di bassa pressione, e comunque non troppo elevate (gas rarefatto), e alte temperature, e comunque non troppo prossime alla temperatura di liquefazione.
La legge non è valida per i liquidi, il cui volume varia assai poco con il variare della pressione (la variazione di densità è del tutto trascurabile fino a livelli di pressione veramente elevati). Inoltre, ad esempio nel mare, al crescere della profondità aumenta la pressione, ma la temperatura diminuisce (anziché aumentare) fino a stabilizzarsi oltre i 100-200 metri.
Rappresentazione grafica di queste condizioni è la campana di Andrews.
I GAS PERFETTI.
In fisica, molto spesso, è conveniente utilizzare un modello di gas che si adatti a delle specifiche condizioni. I gas reali, cioè quelli con cui abbiamo a che fare nel quotidiano, spesso non soddisfano determinate proprietà, e le leggi che abbiamo appena visto non descrivono il loro comportamento.
Per questo, è utile considerare una categoria di gas, che vengono definiti ideali, e sono quelli che soddisfano le due leggi di Gay-Lussac e quella di Boyle. Questi gas, in particolare, devono essere rarefatti, e la loro temperatura deve essere lontana da quella di liquefazione del gas.
p⋅V=n⋅R⋅T
E’ stato dimostrato che, per un gas perfetto, a pressione e temperatura fissati, il volume del gas è direttamente proporzionale al numero di moli del gas.
Definizione di mole:
1 mole è la quantità di sostanza che contiene un numero di Avogadro di particelle ( 6,022 1023 ); o anche (altra definizione).
Un' altra definizione di mole:
si definisce mole la quantità di una sostanza che ha massa numericamente uguale al suo peso atomico o molecolare.
La quantità tra parentesi può essere espressa dal prodotto del numero di moli (n) per la costante R, detta costante universale dei gas, che vale:
R = 8,31 frac(J)(mol * K) = 0,0821 frac(L * atm)(K * mol) R=8,31Jmol⋅K=0,0821L⋅atmK⋅mol
In particolare, è bene tenere in considerazione che in condizioni normali, cioè alla temperatura di 0°C e alla pressione di 1 atm, 1 mole di un gas qualsiasi occupa il volume di 22,4 litri.
RIASSUNTO
Un gas è perfetto se formato da particelle che hanno volume zero, zero forze attrattive tra particella e particella, urti elastici tra ciascuna particella e tutte le altre e tra ciascuna particella e le pareti, e energia cinetica direttamente proporzionale alla temperatura assoluta.






