PESI ATOMICI RELATIVI DEGLI ELEMENTI - Cap. 3.3
Salerno - Domenica, 13/10/2019.
Definizione di massa atomica relativa.
Nella Tavola Periodica sono riportate le masse atomiche relative di tutti gli elementi noti.
Ad esempio, per l' idrogeno, simbolo H, troviamo: P. at. H = 1,0079 dell' H; ciò significa, per definizione, che 1 atomo di H pesa 1,0079 volte di più della dodicesima parte dell’ isotopo 12 del carbonio (126C), posto uguale a 1.
Per l' elemento successivo, l' He, troviamo P.At. He (massa atomica relativa) = 4,0026; ciò significa per definizione, come per l' atomo di H, che 1 atomo di He pesa 4,0026 volte di più della dodicesima parte dell’ isotopo 12 del carbonio (126C), posto uguale a 1.
Per un elemento qualsiasi scelto a caso, ad esempio l' alluminio, troviamo che il P.At. Al = 26,981, e cioè 1 atomo di Al pesa 26,981 volte di più della dodicesima parte dell’ isotopo 12 del carbonio (126C), posto uguale a 1.
Quindi, tutti i valori delle masse atomiche relative degli elementi riportati nella Tavola sono adimensionali, perché espressi mediante numeri puri, senza alcuna dimensione; ad esempio, come prima detto, 1,0079 per l'H, 4,0026 per il C, e 26,981 per l' Al. Pur tuttavia, qualche libro di testo di chimica riporta ancora, come intestazione (titolo) della Tavola Periodica , la doppia definizione: "Tavola Periodica delle masse atomiche relative o dei Pesi Atomici".
Abbiamo poi detto che l' unità di riferimento è l'isotopo 12 del carbonio, senza però aver data una definizione di isotopo. Ebbene, la definizione di isotopo è la seguente:
" Gli isotopi sono le varianti di uno stesso elemento, che hanno lo stesso numero atomico Z (numero di protoni), ma diverso numero di massa A (somma dei protoni e dei neutroni), uguale alla somma dei protoni e dei neutroni del nucleo dell' atomo di Carbonio, riportato in alto a sinistra
prima del simbolo chimico; cioè: 126C, 136C, e 146C.
Dalla differenza tra numero di massa e numero atomico si ricava il numero di neutroni del nucleo dell'atomo di C. Quindi, il 126C ha 6 protoni e 12-6=6 neutroni; il 136C ha ancora 6 protoni e 13-6=7 neutroni; e il 146C ha sempre 6 protoni e 14 - 6=8 neutroni. Il numero di protoni, detto numero atomico , e da cui dipendono la maggior parte delle caratteristiche chimiche e fisiche dell' elemento considerato, è costantemente uguale a 6.
Di seguito si riportano, come esempio, immagini degli isomeri dell' idrogeno e del carbonio.
Isotopi dell’idrogeno (idrogeno, deuterio, e trizio).

Come si vede in figura, il nucleo dell’ idrogeno è formato da un solo protone, ed è presente per il 99,985%; quello del deuterio, da 1 protone ed 1 neutrone (numero di massa 2 - numero atomico 1 = 1 neutrone); infine, quello del trizio, da 1 protone e due (3-1) neutroni. La maggior parte degli elementi hanno isotopi. Solo circa il 20% degli elementi sono rappresentati da un solo isotopo.
Isotopi del carbonio (12C, 13C, 14C).
Diamo ora una rappresentazione degli isotopi del carbonio.In figura, i neutroni sono rappresentati dalle sferette di colore azzurro. Il C 13 è l' isotopo stabile del carbonio. È quello meno abbondante in natura tra gli isotopi stabili del carbonio (1,11%[2]) ed ha 6 protoni e 7 neutroni. Il C 14 è radioattivo. In figura, i neutroni sono rappresentati dalle sferette di colore azzurro. Il C 13 è l' isotopo stabile del carbonio. È quello meno abbondante in natura tra gli isotopi stabili del carbonio (1,11%[2]) ed ha 6 protoni e 7 neutroni. Il C 14 è radioattivo (decade ad azoto, N).
Gli isotopi verranno trattati per esteso in un prossimo capitolo.

Determinazione della massa atomica relativa.
Per determinare la massa atomica relativa dell' elemento ossigeno, si procede in questo modo:
- Si pesa 1 litro di O2 a c.n. (0°C, 1 Atm.): troviamo gr. 1,31.
- Si pesa 1 litro di H2 a c.n. (0°C, 1 Atm.): troviamo gr. 0,082.
- Il rapporto gr. 1,31/gr. 0,082 = 16, massa atomica relativa dell'ossigeno, impropriamente detta peso atomico)
Siccome per il Principio di Avogadro il numero degli atomi di O2 e degli atomi di H2 è lo stesso , possiamo affermare che 1 atomo di ossigeno pesa 16 volte di più di 1 atomo di idrogeno, e quindi la massa atomica dell' ossigeno rispetto all' H (preso come riferimento) vale 16.
Supponiamo invece di voler determinare la massa atomica relativa (peso atomico) del C, che è un solido. Direttamente, non si può!
Possiamo però determinare la massa relativa di 1 litro di CO2 (anidride carbonica), che a c. n. vale 1,81 gr., e cioè pesa 1,81/0,082 = 22 volte di più della molecola di H2, e 22*2=44 volte di più di un atomo di H. E quindi, se dalla massa totale 44 della CO2 sottraiamo la massa dei 2 atomi di ossigeno (2*16=32), otteniamo: 44 - 32 = 12, che rappresenta la massa atomica relativa del C. Quindi, il P.At. relativo del C = 12.
Massa molecolare relativa (Peso molecolare) e Peso formula.
La Massa molecolare relativa (impropriamente detto Peso molecolare) si ricava ovviamente dai pesi atomici che compaiono nella formula. Esempi:
Massa molecolare relativa (Peso molecolare) di O2 = 2 * P.At. O = 2 * 16 = 32
Massa molecolare relativa (Peso molecolare) di H2O = 2 * P.At. H + 1*P.At. O = 2 + 16 = 18
Per il cloruro di sodio, il comune sale da cucina, è improprio parlare di molecola. Infatti, la struttura del NaCl non è la molecola, e cioè un aggregato di due o più atomi, ma è un solido ionico, e cioè è formato da ioni Na+ e ioni Cl- disposti ai vertici di un reticolo cubico (vedi figura).
In questo caso è più corretto parlare di Peso formula, che si ricava così:
Peso formula di NaCl = 1*(P.At. Na) + 1*(P.At. Cl) = 1*22,990 + 35,453 = 58,443.
In modo analogo, possiamo calcolare il peso formula delle seguenti sostanze: H3PO4, Ca3(PO4)2, NH4Cl, KCl, e simili.
Peso atomico medio.
I pesi atomici che figurano nella Tavola Periodica sono pesi atomici medi, o detto meglio, valori medi delle masse atomiche relative.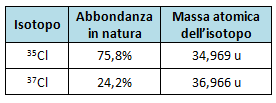
Infatti, tenendo presente i dati in tabella, possiamo calcolare il valore del Peso Atomico medio del Cl (detto meglio: " valore medio della massa atomica relativa del Cl ") .
Peso Atomico medio del cloro (valore medio della massa atomica relativa): (0,758*34,969) + (0,242*36,966) = 35,453.
Come si vede, non è facile liberarsi dalle cattive abitudini. Solo il Tempo farà ammenda di tutto!
Determinazione della massa atomica relativa con lo Spettrometro di Massa.
Dalla differenza tra le due deviazioni si può inoltre stabilire che il rapporto O/C tra le masse dei due atomi è 4/3; siccome per definizione la massa dell'atomo 12C vale 12, quella dell'atomo 16O deve allora corrispondere a 16 (12*4/3=84/12=16).
Link interessanti.
Massa atomica relativa, e massa molecolare relativa.




